Publié le
Lecture 11 mins
Prise en charge de l’allo-immunisation plaquettaire fœto-maternelle
Émeline MAISONNEUVE, Service de médecine fœtale, Centre national de référence en hémobiologie périnatale, DMU ORIGYNE, Hôpital Armand-Trousseau, Paris
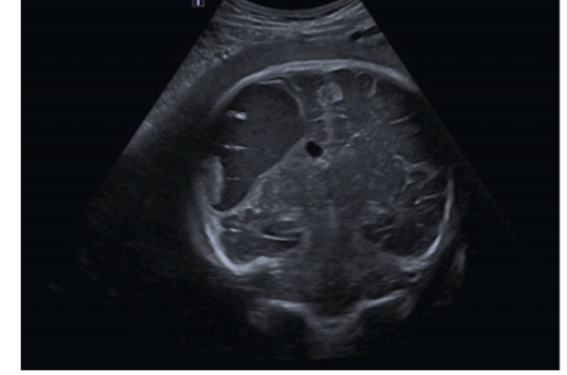
L’allo-immunisation plaquettaire fœto-maternelle est définie par la présence d’allo-anticorps dirigés contre des antigènes plaquettaires que la mère ne possède pas. Le principal risque est la thrombopénie fœtale et/ou néonatale allo-immune (FNAIT : fetal and neonatal allo immune thrombocytopenia) qui peut avoir pour conséquences une hémorragie cérébrale fœtale voire une mort fœtale in utero. L’incidence de la FNAIT est de 1/2 000 naissances(1).
Circonstances de découverte Le taux de plaquettes normal est compris entre 150 et 450 giga/litre (G/L). On parle de thrombopénie lorsque ce taux est inférieur à 150 G/L et de thrombopénie sévère lorsqu’il est inférieur à 50 G/L. Parfois, il arrive qu’une thrombopénie sévère soit découverte par hasard lors d’un bilan sanguin réalisé en période néonatale immédiate pour une autre pathologie. Quelle que soit la raison pour laquelle la numération plaquettaire a été réalisée, il est nécessaire de rechercher une allo-immunisation plaquettaire si cette thrombopénie néonatale est sévère. En effet, la FNAIT est la première cause de thrombopénie néonatale sévère (1). La thrombopénie néonatale est relativement fréquente, en particulier chez les nouveau-nés hospitalisés en réanimation néonatale. Ainsi, il existe d’autres causes de thrombopénie néonatale telles que la prématurité, le retard de croissance intra-utérin, le purpura thrombopénique immun (PTI), l’asphyxie périnatale, l’infection congénitale au cytomégalovirus, etc. En cas de thrombopénie néonatale, une PCR ( polymerase chain reaction) cytomégalovirus doit être réalisée au niveau salivaire ou urinaire chez le nouveau-né. De plus, il ne faut pas confondre la FNAIT avec le PTI, qui est une thrombopénie néonatale liée à la présence d’auto-anticorps antiplaquettes. Physiopathologie de la thrombopénie fœtale et néonatale allo-immune Il existe des antigènes à la surface des plaquettes du fœtus, appelés « human platelets antigens » (HPA), qui sont hérités du père et de la mère. Lorsque le fœtus présente sur ses plaquettes des antigènes hérités du père et que la mère ne possède pas, le système immunitaire de la mère peut fabriquer des anticorps dirigés contre ces antigènes plaquettaires HPA fœtaux. Le transport transplacentaire des anticorps maternels IgG spécifiquement antiplaquettaires est médié par les récepteurs FcRn. Ensuite, ces allo-anticorps anti-HPA induisent une destruction des plaquettes fœtales. Les antigènes HPA ont été retrouvés en quantité normale à la surface des plaquettes fœtales grâce à des ponctions de sang fœtal réalisées à 18 SA (2). En particulier, l’antigène HPA-1 se situe sur la β3 intégrine GPIIIa à la surface des plaquettes (2). C’est l’équivalent plaquettaire de la maladie hémolytique fœtale et néonatale érythrocytaire. Cependant, la FNAIT survient régulièrement dès la première grossesse et les anti-corps anti-HPA-1a ont également une action sur les cellules endothéliales, ce qui augmente le risque hémorragique (3). Diagnostic de thrombopénie fœtale et néonatale allo-immune (FNAIT) Pour établir le diagnostic de thrombopénie néonatale allo-immune, un bilan sanguin doit être fait idéalement en trio : au père, à la mère et au nouveau-né (ou au fœtus) présentant une thrombopénie. Ces bilans sanguins permettent d’identifier les antigènes présents à la surface des plaquettes du père, de la mère et du fœtus/nouveau-né, et de mettre en évidence un allo-anticorps anti-HPA dans le sérum maternel (exemples décrits dans les tableaux 1 et 2). Les systèmes HPA sont bi-alléliques, codominants et antithétiques. Pour chaque système HPA, l’allèle a : est celui qui est de haute fréquence, alors que l’allèle b est de basse fréquence. Le diagnostic d’allo-immunisation plaquettaire n’est posé que si : il existe une ou plusieurs incompatibilités entre les antigènes plaquettaires de la mère et de son enfant (hérités du père), et si la mère a dans sa circulation sanguine des allo-anticorps dirigés contre les antigènes HPA de son fœtus (et donc son conjoint). Prise en charge des prochaines grossesses Pour une prochaine grossesse, l’objectif est d’éviter la survenue d’une hémorragie cérébrale (HIC : hémorragie intracrânienne) chez le fœtus et/ou le nouveau-né. En effet, le risque de récurrence d’HIC lors de grossesses ultérieures HPA-incompatibles est important. Chez les femmes ayant déjà eu un enfant atteint d’une HIC, le taux de récurrence de l’HIC est de 72 % (IC 95 % : 46-98 %) sans tenir compte des décès fœtaux, et de 79 % (IC 95 % : 61-97 %) en tenant compte de ces décès. En extrapolant leurs résultats, les auteurs prédisent qu’en cas d’antécédent de FNAIT sans HIC, le risque de FNAIT avec HIC sur la grossesse incompatible suivante est de 7 % (IC 95 % 0,5- 13 %), ce qui beaucoup plus faible (4). Suivi pluridisciplinaire La première des recommandations passe par une consultation préconceptionnelle. La patiente doit ensuite être suivie par une équipe multidisciplinaire composée d’un obstétricien, d’un hématologue, d’un néonatologue ayant de l’expertise dans cette maladie avec l’appui de biologistes médicaux spécialisés dans le domaine. Lors d’une nouvelle grossesse, il faut tout d’abord statuer sur une éventuelle incompatibilité plaquettaire fœto-maternelle. Selon le type d’antigènes HPA portés par les plaquettes du père, il peut y avoir soit 50 % soit 100 % d’incompatibilité pour toutes les grossesses ultérieures du couple. L’incompatibilité fœto-maternelle peut ainsi être déterminée grâce à un génotypage plaquettaire fœtal. En cas de conjoint homozygote pour le système HPA en cause, il existe 100 % d’incompatibilité pour toutes les grossesses du couple (tableau 1). Dans ce cas, le génotypage fœtal n’est pas nécessaire. En cas de conjoint hétérozygote pour l’antigène impliqué (tableau 2), inconnu ou indisponible, un génotypage fœtal HPA est nécessaire pour établir la compatibilité ou l’incompatibilité fœto-maternelle (5). Idéalement, il est préférable de réaliser un génotypage plaquettaire non invasif sur sang maternel afin de limiter le risque de perte fœtale et de réactivation de l’allo-immunisation. En France, le génotypage plaquettaire pour les systèmes HPA 1, 3, 5 et 15 est réalisable au département d’immunologie plaquettaire du laboratoire du CNRHP (Centre national de référence en hémobiologie périnatale) (6). Il peut être réalisé dès 12 semaines d’aménorrhée (SA) et nécessite un contrôle au moins 2 semaines plus tard pour éviter le risque de faux négatif lié à une quantité d’ADN fœtal libre circulant insuffisante (modalités de prélèvement du département d’immunologie plaquettaire du CNRHP disponibles sur www.cnrhp.fr/docs/PRELEVEMENTS-IP.pdf). Si aucun laboratoire n’est en mesure de réaliser le génotypage fœtal HPA non invasif, il faut faire une amniocentèse dès 16 SA avec génotypage fœtal HPA (un prélèvement invasif sur cellules amniotiques ne nécessite pas de contrôle). En cas d’incompatibilité plaquettaire entre la mère et son fœtus, il faudra vérifier la présence d’allo-anticorps maternels circulants anti-HPA. Les anti-corps les plus fréquemment en cause dans les accidents hémorragiques sont de type anti-HPA-1a. Les allo-anticorps anti-HPA1a et anti-HPA5b sont associés à plus de 95 % des FNAIT chez les patientes caucasiennes (7). Chez les patientes HPA-1bb incompatibles avec leur fœtus, seules 10 % développent des anticorps anti- HPA1a (8). La mise en évidence d’un allo-anticorps maternel spécifiquement antiplaquettaire repose sur la technique MAIPA ( monoclonal antibody immobilization of platelet antigen-test). Les anticorps anti-HPA-1a peuvent être dosés (en UI/mL). Plus leur dosage est élevé, plus le risque de thrombopénie sévère augmente. Les valeurs seuils de dosages d’allo-anticorps anti-HPA-1a établies pour leur valeur prédictive négative de thrombopénie fœtale/néonatale 50 G/L varient selon les études de 3 à 23 UI/mL et sont estimées à 30 UI/mL pour prédire la thrombopénie 20 G/L(9-11). Une augmentation du taux d’anticorps pendant la grossesse est également associée à la FNAIT (12). Dans le bilan d'incompatibilité plaquettaire, il est habituel de réaliser un cross match entre le sang de la mère et celui du père. Un cross match positif est en faveur d’une incompatibilité, sans que celle-ci soit déterminée spécifiquement. Il existe un autre critère biologique prédictif de la FNAIT : les patientes HPA-1bb avec un typage HLA-DRB3*01:01 ont plus de risque de développer des anticorps anti-HPA-1a. Ce typage HLA a surtout une bonne valeur prédictive négative (4,9,13). Traitement pendant la grossesse Le traitement pourra aller, selon l’avis médical pluridisciplinaire, de l’abstention thérapeutique à un traitement qui consiste en des perfusions d’immunoglobulines intraveineuse (IgIV) polyvalentes chez la mère, qui vont viser à empêcher le transfert des allo-anticorps anti-HPA de la mère à travers le placenta et la destruction des plaquettes du fœtus. Ce traitement hebdomadaire commence à partir de 12-16 SA en cas d’antécédent de FNAIT avec HIC. Le traitement par IgIV polyvalentes a fait la preuve de son efficacité uniquement dans cette indication précise sur la diminution du risque de récidive de HIC (4). Une revue systématique sur 27 études a permis de montrer un succès de 98,7 % du traitement par IgIV seules pour éviter le HIC (14). En cas d’antécédent de FNAIT sans HIC, le traitement par IgIV doit être discuté avec la patiente. Si un traitement est décidé, il doit être commencé à 20-22 SA et sans dépasser 24 SA (5). Il est poursuivi chaque semaine jusqu’à l’accouchement. Les IgIV présentent comme tous les médicaments de nombreux effets secondaires, tels que céphalées et nausées. Il faut bien prescrire à la patiente une hydratation importante et du paracétamol pour éviter les céphalées. Il n’existe pas d’étude démontrant l’intérêt d’augmenter la dose à 2 g/kg/ semaine ni d’ajouter des corticoïdes (5,14). Le recours aux gestes invasifs à visée thérapeutique (transfusion in utero de plaquettes) est actuellement abandonné du fait d’un rapport bénéfices/risques très défavorable (3,14). Surveillance pendant la
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante